
 |
|
|
Главная -> Природные воды Природные воды - открытая нестационарная многокомпонентная система Свободный газ в природных водах. Реальные природные воды содержат в своем составе значительное количество микропузырьков газа, обычно покрытых пленками поверхностно-активных веществ (ПАВ), что стабилизирует и сохраняет их от полного растворения [40, 47, 106, 138, 140]. Вода, полностью лишенная таких микропузырьков, в природе практически отсутствует и может быть получена лишь в лабораторных условиях, поэтому свойства ее резко отличны от реальной природной воды [59]. Природные воды, непрерывно поддерживающие контакт с атмосферой, могут быть рассмотрены как трехфазные гетерогенные открытые системы, непрерывно обменивающиеся газом с атмосферой (рис. 1). Происхождение свободных, видимых простым глазом, воздушных пузырьков в природных водах и особенно в океане кажется непонятным. Некоторые пузырьки, вероятно, возникают при захвате воздуха волнами, при выделении газов планктоном и растительными организмами (Оа, СОг). Однако в нормальных условиях большая часть пузырьков возникает, видимо, при увеличении размеров микропузырьков газа, существовавших в столбе воды ранее. Наличие таких зародышевых пузырьков необходимо, поскольку в противном случае для их образования потребовались бы чрезвычайно высокие парциальные давления газов, возможные лишь при максимальном пересыщении ими воды, что не имеет места в природных условиях. Причины возникновения зародышей свободной газовой фазы к настоящему времени дискуссионны. В разделе 3.4 рассмотрены представления авторов о ведущей роли вторичного корпускулярного космического излучения в нарушении оплошности воды и возникновении микропузырьков. Кроме микро- и макропузырьков газов природная вода содержит микрочастицы, органические и неорганические, различные биоорганизмы размерами от долей микрона и более, ионы органических и неорганических веществ, молекулярно-растворенные газы, среди которых особо важное значение принадлежит углекислому газу. Число микрочастиц и газовых пузырьков, различных по оценкам [18, 97, 106], варьирует в природных водах в пределах 10--10 в 1 cм В обычных условиях концентрация свободного газа по сравнению с молекулярно-растворенным очень мала, т. е. аг=Ссв/см. 10-9, где Сев - концентрация свободного, а См. р - молекулярно-растворенного газа [47]. в природных водах этот фактор обычно не учитывают, кроме случая высокогазированных природных вод с большим содержанием природного газа. Размеры микропузырьков газа, обычно присутствующих в природных водах, порядка 1-30 мкм. Миксочастицы, органические и неорганические биоорга-низиы Иихропузнрьни газа Турбулиэация, аихреобраэо-вание (спектр частот и вихрей) Изменение атносфеБНОГо, гидростатического и гидро-динаияческого давления Изменение олтической и ану-стическоЙ плотности всдша сред Изменение диэлектрических свойств ВОДНЫХ сред Увеличение концентрации нв растворимых соединений СаСХ}, MgCOg, Ге(ОН)з я Т.Д. Сдвиг угленислотного равновесия В природаюс водат, изменение рН, COg АТМОСФЕРА ПРИРОДНАЯ ВОДА открытая нестационарная иногокомпонентная гетерогенная трехфазная систеш
в природаш водАг Ионы органических к неорганических вешестБ, комплексные ионы Моленулярно-растворенный газ Изменение температуры осус-лоаливает изменение поверхностного натяжения, вязкости и критического давления пузырьков газа. пара. Изменение минерализации природных вод Изменение электрспроводинас-ти, теплопроводности Измекекие реологических и фильтрационных свойств Продуитн новообрввования при кавитации, всплытие на поверхность жидкости максоп5-зырьков, их Тлопание . уход I атмосферу Коагуляция мивдочастнц, ад-сорйция ионов на органических и неорганических частица! Рис. 1. Изменение гидрофизических и гидрохимических свойств природных вод, обусловленное вариацией концентрации свободных газов. В работе [140] выполнен обзор методов измерения свободного газа в природных водах, даны экспериментальные оценки свободного газа в водопроводной и дегазированной воде, значительно превышающие приведенные в [47]. При длительном отстаивании водопроводной и дегазированной воды коэффициент газосодержания ь согласно [140], определяемый отношением объема свободного газа к единице объема воды ai = CcB. г/см приближается к равновесному значению (рис. 2). При рассмотрении большинства физико-химических свойств природных вод необходимо учитывать содержание в них не только растворенных, но и свободных газов. Природные воды, не содержащие газов или содержащие их в малых количествах, представляют, скорее, исключения, причем концентрации свободного и молекулярного газа в них находятся Рис. 2. Зависи.мость газосодержания ai свежей (/) и деаэрированной (2) водопроводной воды от времени отстаивания [140]. 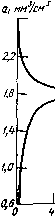 8 Ъсут в подвижном равновесии в зависимости от ряда факторов внешней среды. Поэтому ПВ следует рассматривать как газоводные растворы, в которых существует равновесие водачгаз, причем количество и состав газа определены для каждого вида вод суммарным давлением в жидкости /7==/?а + /г.с + /г. (1) где Ра - атмосферное давление; Pv. с = pg/i - гидростатическое давление, определяемое плотностью жидкости р и глубиной h; g - ускорение свободного падения; рг - гидродинамическое давление, пониженное в центрах вихревых структур в жидкости. Выделение свободного газа из жидкости ускоряется при нагревании и повышении минерализации природных вод. При вихреоб-разовании даже при относительно невысоких скоростях в докави-тационном режиме Ог составляет 10-*-10-, а при развитой кавитации может доходить до 0,1 и более. Аналогичные явления имеют место и при подъеме жидкости из глубин. Вариации свободного газа в природных водах. Одним из наиболее хорошо изученных явлений, обусловливающих переход мо-лекулярно-растворенного газа в свободный, выделяющийся в быстрорастущие газовые пузырьки (а частично и пара), является снижение давления в объеме жидкости и рост температуры.
|